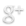Ci sono anche virus buoni: sviluppato un vettore virale fotoattivo per la terapia antitumorale
Messo a punto da un gruppo di ricerca dell’Università di Bologna un fago anti-cancro. Si tratta di un virus innocuo per gli esseri umani, ingegnerizzato geneticamente e modificato chimicamente per eliminare in modo selettivo solo le cellule tumorali. Il trattamento, mirato e non invasivo, viene attivato dalla luce.

Non tutti i virus vengono per nuocere. Un gruppo di ricerca dell’Università di Bologna ha messo a punto una nuova terapia mirata contro il cancro che si basa sull’azione di un fago – un virus che infetta i batteri – geneticamente modificato.
Lo studio – che ha conquistato la copertina della rivista Nanoscale – è stato realizzato nell’ambito del progetto NanoPhage, sostenuto da Fondazione AIRC per la ricerca sul cancro. I risultati mostrano come sia possibile ingegnerizzare un particolare tipo di virus, il fago M13, in modo che possa eliminare selettivamente solo le cellule tumorali. A questo scopo il virus è stato modificato in modo tale da avere la capacità di trasportare sulle cellule tumorali da colpire un farmaco che può essere attivato attraverso la luce.
“Oggi più che mai sappiamo che i virus possono essere pericolosi avversari per gli esseri umani. È tuttavia importante ricordare che alcuni virus possono rivelarsi preziosi alleati nella lotta contro le malattie, compreso il cancro”, spiega Matteo Calvaresi, professore al Dipartimento di Chimica “Giacomo Ciamician” dell’Università di Bologna e coordinatore dello studio.
I batteriofagi, o più semplicemente fagi, sono virus molto diffusi che colpiscono i batteri, ma sono innocui per le piante, gli animali e gli esseri umani. Per questa caratteristica, e per la loro particolare struttura, si prestano a essere modificati geneticamente ed a essere così trasformati in vettori in grado di trasportare farmaci in modo mirato all’interno di un organismo.
Gli studiosi hanno sperimentato questa opportunità con il fago M13, un virus filamentoso lungo 1000 nanometri ma largo appena 5 (un nanometro equivale a un miliardesimo di metro). Per le sue caratteristiche questo virus può diventare una piattaforma efficace per ospitare e trasportare nanomateriali. In particolare, l’obiettivo era trasformare il virus in uno strumento per implementare una terapia fotodinamica anticancro: un trattamento mirato e non invasivo, attivabile con impulsi luminosi.

“Abbiamo utilizzato questo fago per trasformarlo in un veicolo in grado di indirizzare sulla superficie delle cellule tumorali svariate centinaia di molecole, che vi penetrano poi all’interno attraverso un processo, chiamato endocitosi, mediato da recettori”, dice Luca Ulfo, dottorando dell’Università di Bologna e co-primo autore dello studio.
I ricercatori hanno modificato geneticamente il fago per colpire selettivamente uno specifico recettore, chiamato EGFR, che viene espresso in eccesso in diversi tipi di tumore, compresi quelli al seno, ai polmoni, al cervello ed al colon. In questo modo il virus raggiunge solo le cellule tumorali. Inoltre, sull’involucro proteico che circonda il genoma del virus sono state attaccate chimicamente alcune molecole che permettono l’attivazione della terapia fotodinamica.
“Queste molecole sono composti, chiamati fotosensibilizzatori, che possono essere attivati da uno stimolo luminoso. Inoltre, sono in grado di trasformare l’ossigeno normalmente presente nel nostro organismo in un agente chimico altamente reattivo, capace di uccidere le cellule tumorali”, aggiunge Andrea Cantelli, ricercatore dell’Università di Bologna e co-primo autore dello studio.
La capacità del virus così modificato di riconoscere in modo mirato le cellule tumorali e la possibilità di controllare con precisione l’area in cui attivare la terapia, irradiandola con la luce, sono caratteristiche che potrebbero contribuire a ridurre drasticamente gli effetti collaterali delle terapie antitumorali. I risultati ottenuti sono il primo importante passo per arrivare a una sperimentazione clinica di questo vettore virale, che potrebbe anche trovare ulteriori applicazioni mediche.
“La particolarità di questo nuovo strumento sta nella grande flessibilità offerta dalla biologia del fago, che permette di sviluppare approcci innovativi nel campo della teranostica, della biosensoristica e della medicina di precisione”, spiega Alberto Danielli, professore al Dipartimento di Farmacia e Biotecnologie dell’Università di Bologna, tra i coordinatori dello studio. “Oltre alla specifica applicazione che abbiamo realizzato, il virus potrebbe essere modificato in altri modi, per raggiungere cellule anche di diverso tipo, e persino per combattere batteri patogeni che hanno sviluppato resistenza agli antibiotici”.
I risultati sono stati pubblicati sulla rivista Nanoscale nell’articolo dal titolo “Orthogonal nanoarchitectonics of M13 phage for receptor targeted anticancer photodynamic therapy”. Lo studio è stato realizzato da un gruppo di ricerca che ha coinvolto tre dipartimenti dell’Università di Bologna: Luca Ulfo, Annapaola Petrosino, Paolo Emidio Costantini, Michela Nigro, Francesco Starinieri, Suleman Khan Zadran, Giampaolo Zuccheri e Alberto Danielli (Dipartimento di Farmacia e Biotecnologie); Andrea Cantelli, Roberto Saporetti, Matteo Di Giosia e Matteo Calvaresi (Dipartimento di Chimica “Giacomo Ciamician”); Eleonora Turrini (Dipartimento di Scienze per la Qualità della Vita). La ricerca è stata resa possibile grazie al progetto NanoPhage, sostenuto da Fondazione AIRC per la ricerca sul cancro ed attivo presso il NanoBio Interface Lab.
MDG
(si ringrazia l’Università di Bologna per le informazioni)